铜与稀硝酸的反应的化学方程式|铜与稀硝酸的反应
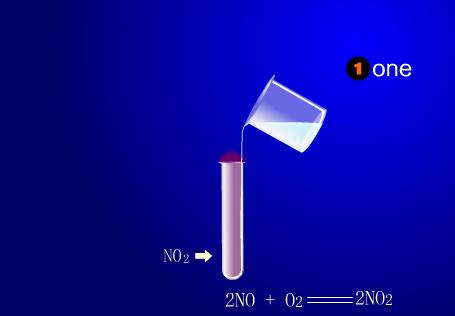

实验演示
操作方法
按图装好实验装置,并检验这一装置气密性。在烧瓶里放3--4片铜片,再打开漏斗活塞,将稀硝酸放入烧瓶,直至浸没铜片为止,观察现象,然后再把烧瓶加热,用排水法收集一试管气体。

实验现象
铜片中假如稀硝酸不加热时,仅有少量气泡产生,当给烧瓶加热时,产生大量气泡,试管中收集到气体为无色,在水面下用拇指堵住试管口,把试管从水中取出,并使管口向上,放开拇指,试管口处气体变为红棕色。烧瓶内溶液呈蓝色。
实验结论
铜与稀硝酸在不加热时反应缓慢,在加热时反应速度较快,有无色NO气体生成,同时生成硝酸铜,反应方程式:3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO ↑ + 4H2O
实验考点
1、金属与稀硝酸反应规律;2、金属活动性顺序表中H后面的金属与氧化性酸的反应特点与计算。
经典考题
1、0.3molCu与足量的稀HNO3完全反应时,被还原的HNO3的物质的量是
A、0.8mol B、0.6mol C、0.4mol D、0.2mol
试题难度:易
2、向1L0.5mol/L的H2SO4溶液中加入10.1gKNO3和12.8gCu充分反应后产生的气体在标态下的体积为( )
A、2.24L B、3.36L C、4.48L D、5.60L
试题难度:中
3、已知锌和稀硝酸反应时,每有1mol硝酸反应,就有0.8mol电子转移,此时硝酸的还原产物可能是什么物质?并写出有关化学方程式。
试题难度:难
1 答案:D
解析:直接考查方程式,硝酸同时体现氧化性和酸性,3摩尔铜参加反应时被还原的硝酸是2摩尔。
2 答案:A
解析:根据铜和稀硝酸反应的离子方程式进行计算,硫酸提供氢离子,硝酸钾提供硝酸根离子,判断硝酸根不足,根据硝酸根进行计算可得。
3 答案:还原产物可能是N2O或是NH4NO3。
4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O
4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O
解析:利用电子得失守恒计算,10摩尔硝酸参加反应就有8摩尔电子转移,即有4摩尔的金属锌参加反应,同时生成4摩尔硝酸锌,那么体现酸性的硝酸就是8摩尔,只有2摩尔的硝酸得8摩尔电子,平均每摩尔硝酸得电子4摩尔,产物为 N2O ,当然还有一种可能是只有其中的1摩尔硝酸得到8摩尔电子到-3价,最后产物为硝酸铵。
氧化性酸
氧化性酸——一般是含氧酸,是指酸中除了氢、氧元素之外的中心元素在化学反应中表现出强氧化性。比较常见的有:浓、稀硝酸,浓硫酸,次氯酸,氯酸,亚氯酸,高氯酸,亚硝酸等。
比氢离子氧化性强的含氧酸,其酸根里的中心原子处于较高的价态。反应中比氢离子易得电子。常见的氧化性酸有浓硫酸、浓硝酸、稀硝酸、亚硝酸及氯、溴、碘的含氧酸。从标准电极电势的数值上看,它们比氢离子的电势大得多。
氧化性酸的强氧化性表现在:
①能与排在常见金属活动性顺序表中氢后面的金属单质反应,能将变价金属从零价氧化成较高的价态。例如:
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
2Fe+6H2SO4(浓)=Fe2(SO4)3+3SO2↑+6H2O
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
②能与不太活泼的非金属单质反应,例如:
C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
P+5HNO3(浓)=H3PO4↑+5NO2↑+H2O
I2+10HNO3(浓)=2HIO3↑+10NO2↑+4H2O
③能与许多含较低价态元素的化合物反应,例如:
4HNO3(稀)+FeS=Fe(NO3)3+S↓+NO↑+2H2O
HClO+H2SO3=HCl+H2SO4
氧化性酸的氧化性强弱,存在以下规律:
①对于同一种氧化性酸,浓度越大(或溶液中氢离子浓度越大)氧化性越强。例如,浓硝酸比稀硝酸氧化性强。从电极电势上看,增大酸根或氢离子的浓度,氧化能力增强,例如:
硝酸根及氢离子浓度增大(尤其是氢离子浓度)电极电势的值变大。
②对于同一种元素形成的不同价态的含氧酸,一般低价态的比高价态的氧化性强,例如:
HClO>HClO2>HClO4
HNO2>HNO3
③同周期主族元素形成的最高价含氧酸,从左到右,氧化性依次增强,例如,高氯酸常温下氧化性很强,硫酸浓度大加热时才表现出强氧化性,磷酸则几乎无氧化性。相应的低价态含氧酸也有类似的规律,例如,氯酸比亚硫酸氧化性强,溴酸比亚硒酸氧化性强。
④同主族元素形成的同价态含氧酸,氧化性强弱的规律复杂,常见各族元素含氧酸的氧化性强弱顺序:
HBrO4≈H5IO6>HClO4
HBrO3>HClO3>HIO3
HClO>HBrO>HIO
H2SeO4≈H6TeO6>H2SO4
HNO3>H3AsO4>H3PO4
探讨课题金属的活动性对硝酸的还原产物有影响吗?有什么影响?
最新评论共有 5 位网友发表了评论 查看所有评论lc8cflxyz77(58.18.137.*) 发表于2009-5-25 15:47:26可能的还原产物是 N2 N2O NO NO2lc8cflxyz77(58.18.137.*) 发表于2009-5-25 15:47:14有,金属活动性顺序从K到Mg对应的硝酸盐受热分解生成亚硝酸盐与氧气 金属活动性顺序从Mg到Cu对应的硝酸盐受热分解生成金属氧化物,NO2,O2 金属活动性顺序从Cu后的金属对应的硝酸盐受热分解生成金属单质,NO2,O2lc8cflxyz77(58.18.137.*) 发表于2009-5-25 15:45:56可能的还原产物是 N2 N2O NO NO2lc8cflxyz77(58.18.137.*) 发表于2009-5-25 15:44:26呗→被!! 郁闷打错字!lc8cflxyz77(58.18.137.*) 发表于2009-5-25 15:43:49有影响. 金属的活动性不一样 就意味着金属的还原性也不一样 被硝酸氧化的氧化产物也就不同 因为呗氧化的程度不一样了.发表评论
评论内容:不能超过250字,需审核,请自觉遵守互联网相关政策法规。
本文来源:https://www.oubohk.cn/huaxue/58771/
铜和稀硝酸反应 铜和稀硝酸离子方程式 铜和稀硝酸反应方程式


![[从2000年开始]从260分到603分 一个差生创造的高考奇迹](http://img1.zxxk.com/2012-7/ZXXKCOM201207190919292045536.jpg)
![[霸王龙的故事]早期霸王龙种类个头小不及人类](http://img.zxxk.com/2015-6/ZXXKCOM201506191001359817868.jpg)
