氢氧化铝的制备实验视频_氢氧化铝的制备实验





实验演示
操作方法
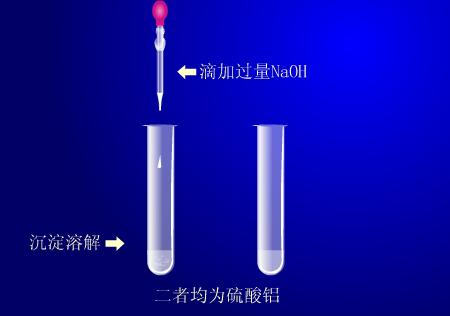
在两个试管里各加入硫酸铝溶液,然后分别滴加NaOH溶液和氨水,直至产生大量的沉淀为止。再将NaOH溶液加至过量,氨水也加至过量,观察现象。将产生沉淀过滤,用蒸馏水冲沉淀后取少量放在蒸发皿里,加热,观察现象。
实验现象
向溶液中加入NaOH溶液和氨水后都有白色蓬松胶状沉淀产生,当NaOH溶液加至过量时,沉淀消失,氨水加至过量时,沉淀无变化。所以制取氢氧化铝时要控制碱的量,一般采用氨水与铝盐反应制备。当将沉淀过滤出来并洗涤后放蒸发皿中加热可以看到有大量水蒸气放出,生成白色粉末。
实验结论
铝盐与碱反应产生氢氧化铝沉淀,氢氧化铝溶于强碱、不溶于弱碱。将沉淀过滤、洗涤、加热蒸干后,分解生成白色粉末氧化铝,放出水蒸气。
实验考点
1、制备氢氧化铝对酸碱的要求;2、氢氧化铝的不稳定性;3、氢氧化铝的计算。
经典考题
1、实验室制取氢氧化铝的一般方法是:
A、可溶性铝盐和强碱 B、可溶性的铝盐和可溶性的弱碱
C、单质铝和酸反应后再和碱反应 D、单质铝和碱反应后再和酸反应。
试题难度:易
2、用铝、稀硫酸和氢氧化钠溶液为原料,实验室制备一定量的氢氧化铝。可采用如下化学方程式表示的两种方法:
①2Al+3H2SO4=Al2(SO4)3+3H2↑ Al2(SO4)3+6NaOH=2Al(OH)3↓+Na2SO4
②2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4
(1)上述哪一种方法比较节约试剂?[提示:试从每生产2摩尔氢氧化铝所消费的试剂用量予以说明]
(2)原料相同,请设计一种更为节约试剂的方法(以方程式表示,并说明其可以最节约试剂的根据。)
试题难度:中
3、锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的化学方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化钠的原因 。
试题难度:难
1 答案:B
2 答案:(1)方法②比较节约试剂。因为同样制取2摩尔氢氧化铝方法①需2摩尔铝,3摩尔硫酸,6摩尔氢氧化钠。方法②需2摩尔铝,1摩尔硫酸,2摩尔氢氧化钠。
(2)更为节约的方法③为①2Al+3H2SO4=Al2(SO4)3+3H2↑
②2Al+2H2O+2NaOH=2NaAlO2+3H2↑
③Al2(SO4)3+6NaAlO2+12H2O=8Al(OH)3↓+3Na2SO4
因为同样制取2摩尔氢氧化铝需2摩尔铝,3/4摩尔硫酸,1.5摩尔氢氧化钠。
3 答案:(1)AlO2-[或Al(OH)4-]
(2)Zn+2NaOH?Na2ZnO2+H2↑[或Zn+2NaOH+2H2O?Na2Zn(OH)4+H2↑]
(3)①③④
(4)Al3++3NH3·H2O?Al(OH)3↓+3NH4+
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制
解析:铝、氧化铝、氢氧化铝与强酸反应时都生成碱根Al3+的溶液,与强碱反应时都生成酸根AlO2-的溶液。锌和铝相似,但是化合价不同,酸根的表达形式有差异:ZnO22-。另外,Al不与弱碱氨水反应,但锌、氧化锌、氢氧化锌可以,这是二者的区别。
医药级氢氧化铝简介
氢氧化铝干凝胶 别名:干燥氢氧化铝凝胶 分子式:Al(OH)3 分子量:78.00
用途:用于肠胃类抑止胃酸用原料药,常用作复方制剂如维U颠茄铝胶囊、氢氧化铝片等主要组份,亦可用于药用辅料。
性状:白色粉末、无臭无味。不溶于水和乙醇,溶于稀无机酸如盐酸。
主要控制指标:制酸力:不少于230mL/g,含量:按三氧化二铝计不得少于48.0%(按氢氧化铝计不得少于76.5%)。
包装储运
内包用双层聚乙烯塑料袋,外用单层聚乙烯塑料编织袋或纸塑复合袋、纸板桶包装;每袋净重20kg。
应贮存在干燥的库房中。包装应完整密封,防止受潮。不可与酸类商品共贮混运。
顿体积:2.8立方米/吨。
鉴别:取本品的细粉适量(约相当于氢氧化铝0.5g),加稀盐酸10mL,加热溶解后,过滤,滤液显铝盐的鉴别反应。
药理毒理
Al(OH)3(医学称胃舒平)对胃酸的分泌无直接影响,对胃内已存在的胃酸起中和或缓冲的化学反应,可导致胃内pH值升高,化学方程式为:Al(OH)3 + 3HCl === AlCl3 + 3H2O从而使胃酸过多的症状得以缓解。其中和酸的能力比含镁制剂和碳酸钙低,而比碳酸铝、碳酸双羟铝钠为高。另外,铝离子在肠内与磷酸盐结合成不溶解的磷酸铝自粪便排出。
药代动力学
极少量的本品在胃内转变成可溶性的氯化铝被吸收,并从尿中排泄,大部分铝离子在肠内结合成不溶解的铝盐如:磷酸盐、碳酸盐及脂肪酸盐,自粪便排出。本品起效缓慢,在胃内作用时效的长短与胃排空快慢有关。空腹服药作用可持续20~30分钟,餐后1~2小时服药时效可能延长到3小时。
适应症
能缓解胃酸过多而合并的反酸等症状,适用于胃和十二指肠溃疡病,及反流性食管炎的治疗;与钙剂和维生素D合用时可治疗新生儿低钙血症(手足搐搦症)。尿毒症患者服用大剂量氢氧化铝可减少磷酸盐的吸收,减轻酸血症。
特点
抗酸作用慢、持久、较强,有收敛作用,有粘膜保护作用,导致便秘,不产生CO2,无酸反跳,无碱血症。
本文来源:https://www.oubohk.cn/huaxue/57671/
实验室制备氢氧化铝 明矾制备氢氧化铝 氢氧化铝胶体的制备



![[物理学中f表示什么]物理学表示职业运动员跑步姿势都错了](http://img.zxxk.com/2015-10/ZXXKCOM201510061049548887060.jpg)