过氧化氢在二氧化锰催化下分解|氯化铁催化过氧化氢分解实验的异常现象探究
氯化铁催化过氧化氢分解实验的异常现象探究
苏教版化学2(必修)第29页[实验3]:用氯化铁作催化剂探究不同浓度的过氧化氢分解反应速率的快慢。笔者在实验过程中发现异常现象:将几滴氯化铁溶液滴到5mL双氧水溶液中,溶液颜色立刻变为棕黄色。双氧水是无色的,0.2mol/L的氯化铁溶液是黄色的,怎么两者加在一起就变为棕黄色了呢?对此,笔者有各种猜想,并用实验加以验证。
猜想一、双氧水分解是放热反应,温度升高,促使Fe3+水解为Fe(OH)3,棕黄色是由Fe(OH)3引起的。
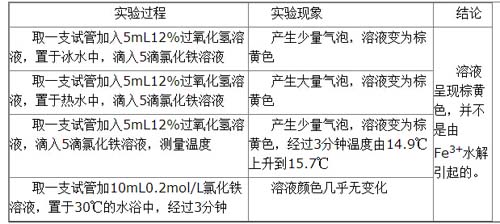
猜想二、过氧化氢中有碱性物质,导致Fe3+与OH-结合为Fe(OH)3,棕黄色是由Fe(OH)3引起的。

猜想三、反应过程中形成的“中间活化络合物”导致溶液变为棕黄色。

[理论解释] H2O2是二元弱酸,能发生电离H2O2 ——> HO2-+ H+,该过程产生HO2-,而Fe3+外层有空的轨道可以与HO2-形成中间活化物,该物质在水溶液呈现棕黄色。
(作者:董葵娜 浙江省奉化中学 )
来源:查字典 化学网
本文来源:https://www.oubohk.cn/huaxue/359521/
过氧化氢的催化分解实验 少量锰离子可以催化分解过氧化氢




