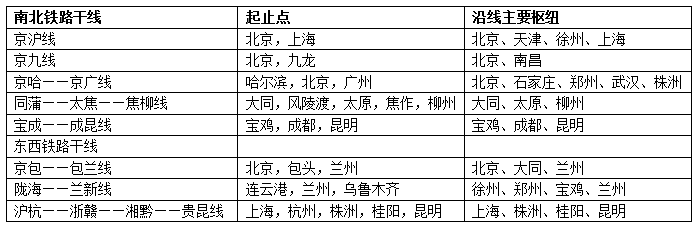
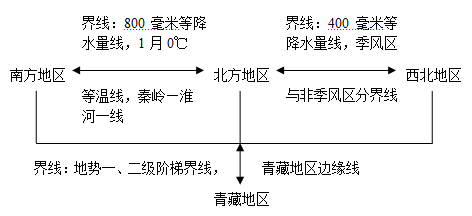
醋酸是弱电解质吗|验证醋酸是弱电解质的十种实验方案
方案一 配制某浓度的醋酸溶液,向其中滴入几滴甲基橙试液,然后再加入少量醋酸钠晶体,振荡。
现 象 溶液由红色逐渐变为橙色。
原 理 醋酸是弱电解质,其水溶液中存在着电离平衡:ch3cooh === ch3coo-+h+ 。
根据化学平衡移动原理,在醋酸溶液中加入醋酸钠晶体后,溶液中的醋酸根离子浓度增大,醋酸电离平衡向左移动,导致h+浓度减小,因此溶液由红色逐渐变为橙色。
方案二 配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液。
现 象 溶液由无色变为浅红色。
原 理 醋酸钠是强碱弱酸盐,溶于水后要发生水解,其水溶液中存在着水解平衡:ch3coo- + h2o === ch3cooh + oh- 。根据盐类水解理论,醋酸根离子与水电离出的氢离子结合生成弱电解质醋酸,破坏了水的电离平衡,导致氢氧根离子浓度大于氢离子浓度,使溶液显碱性。
方案三 称取一定量的无水醋酸配制0.1mol/l的醋酸溶液,测定该溶液的ph。
现 象 测出的ph>1。
原 理 因为醋酸为弱酸(弱电解质),在水溶液中只有部分电离,所以0.1mol/l的醋酸溶液中的h+ 浓度小于0.1mol/l,溶液的ph>1。
方案四 在烧杯里加入浓醋酸,接通电源,然后缓缓加入蒸馏水并不断搅拌,观察电流表中电流强度的变化。
现 象 电流表中电流强度先逐渐变大,然后逐渐变小。
原 理 强电解质浓溶液成倍稀释时,导电能力是成倍减弱的;而弱电解质浓溶液在稀释时,
因大部分弱电解质尚未电离,在加入少量水后,弱电解质电离程度增大,电离出的离子数目增加其增加的幅度大于稀释的影响,导电性增强(表现为电流表中电流强度增大); 变成稀溶液后,电离程度虽然增大,稀释的影响大于离子数目增加的影响,导电性又逐渐减弱(表现为电流表中电流强度减小)。
方案五 配制浓度相同的盐酸和醋酸,取相同体积分别同时加入如上图所示的两个装置的烧杯中,接通电源。
现 象 通过电流表的电流强度:盐酸>醋酸。
原 理 电解质溶液的导电能力与溶液中自由移动的离子的浓度及离子所带的电荷有关。因为盐酸和醋酸都是一元酸,盐酸中电流强度大于醋酸中的电流强度,说明盐酸中离子浓度大,醋酸中离子浓度小,而盐酸是强电解质,因此醋酸是弱电解质。
方案六 配制ph相同的盐酸和醋酸溶液,取1ml上述盐酸和醋酸分别用蒸馏水稀释相同倍数(如100倍),再测定稀释后两溶液的ph。
现 象 盐酸ph变化大,醋酸ph变化小。
原 理 盐酸是强电解质,在溶液中完全电离,因此稀释后h+的物质的量不变,浓度则变为原来的1/100,ph增大2个单位;对于醋酸,因为存在电离平衡,加水稀释时电离平衡向右移动,虽然使醋酸电离产生的h+的物质的量增大,但由于体积增大了100倍,增大幅度远远大于h+ 的增大幅度,所以在稀释后h+浓度减小,但比原来的1/100要大,故其ph增大值小于2个单位。
方案七 配制相同浓度的盐酸和醋酸,分别测定两溶液的ph。
现 象 盐酸溶液的ph小,醋酸溶液的ph大。
原 理 ph与溶液中h+浓度大小有关,h+浓度越大ph越小。盐酸是强电解质,在溶液中完全电离,因此盐酸溶液中:c(h+)= c(hcl);醋酸是弱电解质,在溶液中只有部分电离,溶液中:c(h+)< c(ch3cooh)。由此可见,当两溶液浓度相等时,盐酸溶液中h+浓度大于醋酸溶液中h+浓度,所以盐酸溶液的ph小,醋酸溶液的ph大。
方案八 配制浓度相同的盐酸和醋酸溶液,加入纯度、质量都相同的同种锌粉。
现 象 两溶液与锌反应产生氢气的速率:盐酸>醋酸。
原 理 相同温度时,锌与酸溶液反应生成氢气的速率与溶液中的h+浓度大小有关,h+浓度越大生成氢气的反应速率越大。因为盐酸是强电解质,醋酸是弱电解质,当溶液浓度相同时,盐酸中h+浓度大于醋酸溶液中h+浓度,所以两溶液与锌反应产生氢气的速率:盐酸大于醋酸。
方案九 用已知浓度的盐酸和醋酸溶液分别配制ph=1的两种溶液,取相同体积加入足量的锌,用排水法收集生成的氢气。
现 象 两溶液中生成的氢气体积:醋酸>盐酸。
原 理 足量的锌与同类型的酸反应生成氢气的多少,与溶液中含酸的物质的量成正比,酸的物质的量越大生成的氢气越多。由于盐酸是强电解质,在水溶液中完全电离,而醋酸是弱电解质,只有部分电离,当两溶液ph相等(即h+浓度相等)时,醋酸的浓度大于盐酸的浓度;在体积和ph都相等时,醋酸的物质的量大于盐酸的物质的量。因此,等体积等ph的两溶液与足量锌反应是,醋酸生成的氢气多。
方案十 配制相同ph的盐酸和醋酸溶液,分别取相同体积,用酚酞试液作指示剂,以氢氧化钠溶液为标准溶液进行滴定。
现 象 两溶液消耗naoh标准溶液的体积:醋酸>盐酸。
原 理 酸碱完全中和时,消耗碱的多少与酸溶液中所含酸的物质的量成正比。因为盐酸是强电解质,醋酸是弱电解质,所以在等体积等ph的盐酸和醋酸溶液中,醋酸的物质的量大于盐酸的物质的量,与naoh溶液完全中和时,醋酸消耗的naoh溶液多。
本文来源:https://www.oubohk.cn/yuwen/713/
证明醋酸是弱电解质的方法

![[学校2015]2015秋晋教版地理八年级上册复习提纲:黄土高原—水土流失严重的地区](http://img.zxxk.com/2015-11/ZXXKCOM201511181040417399954.png)
![[学校2015]2015秋晋教版地理八年级上册复习提纲:长江三角洲](http://img.zxxk.com/2015-11/ZXXKCOM201511181043109130562.png)