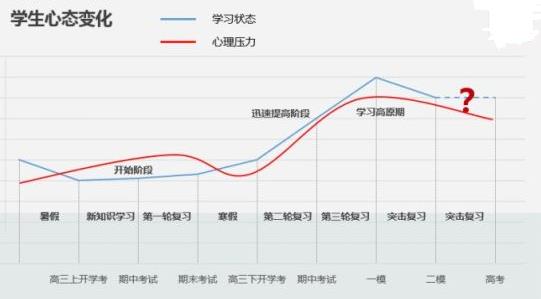
硝酸铜受热分解|硝酸铜的分解
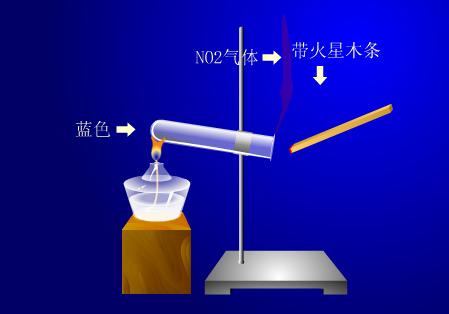
实验演示
操作方法
给装有硝酸铜的试管加热至熔融,用带有火星的细木条伸到试管口检验放出的气体,并观察固体颜色变化。
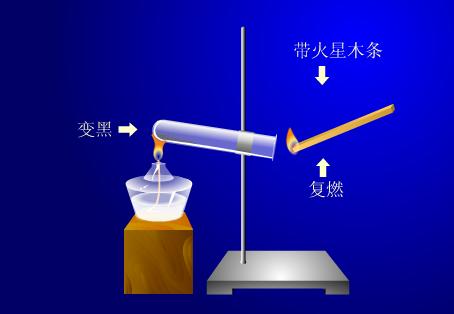
实验现象
带火星木条复燃,固体由蓝色变成黑色,并有红棕色气体产生。
实验结论
硝酸铜受热融化后分解,产生红棕色气体NO2和使木条复燃的氧气,同时有氧化铜产生。
反应方程式为:2Cu(NO3) 2 2CuO+4NO2↑+O2↑
2 2CuO+4NO2↑+O2↑
实验考点
1、硝酸盐分解规律与分解方式;2、分解产物的性质与计算。
经典考题
1、取一定质量的硝酸铜加热使其分解,收集反应生成的气体一试管倒扣在盛水的水槽中水上升到试管的高度为试管的
A、1/2 B、2/3 C、 1 D、 无法确定
试题难度:易
2、硝酸银受热分解,2AgNO3  2Ag+2NO2↑+O2↑,设反应中生成NO2 300mL,用排水法收集生成的气体,收集到的气体(体积在同温同压下测定)是( )
2Ag+2NO2↑+O2↑,设反应中生成NO2 300mL,用排水法收集生成的气体,收集到的气体(体积在同温同压下测定)是( )
A.O2,体积是75mL B.NO,体积是40mL
C.NO2,体积是100mL D.O2,体积是150mL
试题难度:中
3、某学生根据高中课本中硝酸钾受热分解的实验操作来判断硝酸铜的分解产物之一是氧气的原理来做下面的实验:
将试管中的硝酸铜加热到熔融,把带有火星的细木条伸进试管口,检验放出的气体,当发现木条复燃时该学生即断言,硝酸铜受热分解有氧气放出。请你对实验及结论的合理性作出评价。如有必要,可提出改进的实验方案。
你认为上面这个同学的观点对不对?
试题难度:难
1 答案:C
解析:硝酸铜分解生成的二氧化氮和氧气的体积比是4:1,在有水存在时正好完全反应生成硝酸。
2 答案:A
解析:硝酸银分解生成的氧气和二氧化氮在有水时发生4:1反应,氧气过量。
3 答案:上述实验及结论在科学上是错误的。由于NO2干扰了O2的检验,因此应用NaOH溶液除掉NO2后再检验之。
解析:2Cu(NO3) 2 2CuO+4NO2↑+O2↑ 硝酸铜分解除生成氧气外还有NO2 生成,而且还与空气中O2的含量相近,空气不能使带火星的木条复燃,所以带火星的木条复燃应是NO2 所致。
2 2CuO+4NO2↑+O2↑ 硝酸铜分解除生成氧气外还有NO2 生成,而且还与空气中O2的含量相近,空气不能使带火星的木条复燃,所以带火星的木条复燃应是NO2 所致。
(1)硝酸盐在受热时易分解并放出氧气。
①含氧酸不稳定,其对应的盐受热也易分解。
②高温时硝酸盐是强氧化剂:分解时生成氧气。
(2)硝酸盐受热分解规律:
①金属活动顺序表中从K到Mg对应的盐受热分解生成亚硝酸盐和氧气。
Ca(NO3)2= Ca(NO2)2+O2↑
②金属活动顺序表中从Mg到Cu对应的盐受热时生成金属氧化物、NO2和O2。
2Cu(NO3)2  2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
注意:此类盐受热后的产物通入水中没有气体剩余:4NO2+O2+H2O=4HNO3
③金属活动顺序表中Cu以后的金属对应的盐受热时生成金属单质,NO2和O2。
2AgNO3  2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
本文来源:https://www.oubohk.cn/huaxue/58701/
硝酸铜受热分解的化学方程式 硝酸铜加热分解方程式